Notwendigkeit der Entwicklung von Falldefinitionen und Richtlinien für die Datenerhebung, -analyse und -präsentation für angeborene Anomalien als unerwünschtes Ereignis nach der Immunisierung.Angeborene Anomalien, die allgemein auch als Geburtsfehler, angeborene Störungen, angeborene Fehlbildungen oder angeborene Anomalien bezeichnet werden, sind Zustände pränatalen Ursprungs, die bei der Geburt vorhanden sind und möglicherweise die Gesundheit, Entwicklung und/oder das Überleben eines Säuglings beeinträchtigen. Wir werden in diesem Bericht den Begriff angeborene Anomalien verwenden. Angeborene Anomalien umfassen ein breites Spektrum struktureller und funktioneller Anomalien, die isoliert (d. h. ein einzelner Defekt) oder als Gruppe von Defekten (d. h. mehrere Defekte) auftreten können. Mehrere Defekte können als Teil gut beschriebener Assoziationen auftreten, wie z. B. das nicht zufällige gemeinsame Auftreten von Wirbelanomalien, Analatresie, Herzfehlern, tracheoösophagealen Fisteln und/oder Ösophagusatresie, Nieren- und Radiusanomalien und Gliedmaßendefekten (VACTERL )
Angeborene Anomalien sind sehr unterschiedlich ausgeprägt. Einige angeborene Anomalien sind mit Spontanabort, Totgeburt oder Tod in der frühen postnatalen Phase verbunden. Die weltweiten Todesfälle aufgrund angeborener Anomalien gingen von 750,6 000 im Jahr 1990 auf 632,1 000 im Jahr 2013 zurück, mit entsprechenden altersstandardisierten Sterberaten von 11,0 bzw. 8,7 pro 100.000 Subtypen tödlicher angeborener Anomalien (mit einer geschätzten Anzahl von Todesfällen weltweit im Jahr 2013 in Tausend) sind angeborene Herzanomalien Neuralrohrdefekte (68,9), Down-Syndrom (36,4) und chromosomale unausgeglichene Umlagerungen Andere angeborene Anomalien haben möglicherweise nur geringe Auswirkungen auf das Überleben. Anomalien, die die Lebenserwartung, den Gesundheitszustand, die körperliche oder soziale Funktionsfähigkeit eines Säuglings beeinträchtigen, können als „große“ Anomalien bezeichnet werden. Im Gegensatz dazu sind „geringfügige“ Anomalien solche mit geringen oder keinen Auswirkungen auf die Gesundheit oder kurz- oder langfristige Funktion Wir haben uns entschieden, uns bei dieser Falldefinition auf größere Anomalien zu konzentrieren, da sie Auswirkungen auf die öffentliche Gesundheit und bereits bestehende Strukturen für die Überwachung und Berichterstattung durch große nationale und internationale Organisationen haben.Die Ursachen angeborener Anomalien sind weitreichend, wobei viele Anomalien von unbestimmter Ätiologie verbleiben. Strukturelle Anomalien sind häufig auf Fehler in der Embryogenese zurückzuführen, die in kritischen Phasen der fötalen Entwicklung auftreten. Kritische Expositionszeiten während der Schwangerschaft können je nach Organsystem oder Art der Anomalie variieren. Das erste Trimester (Schwangerschaftsalter 1–13 Wochen) gilt jedoch allgemein als Zeitraum mit dem höchsten Risiko. Medikamente, Infektionserreger und Umweltgifte wurden alle als Teratogene in Verbindung gebracht; illegale Drogen und andere mütterliche Expositionen können auch die fetale Entwicklung stören und das Risiko für eine oder mehrere angeborene Anomalien erhöhen .Einige strukturelle und viele funktionelle Defekte werden zugrunde liegenden genetischen Defekten oder Chromosomenanomalien zugeschrieben. Diese Defekte können darauf zurückzuführen sein, dass ein oder beide Elternteile genetische Träger sind, ein oder beide Elternteile den Krankheitszustand teilen oder das Auftreten von De-novo-Mutationen .Der Zeitpunkt der klinischen Erkennung größerer Anomalien variiert sowohl nach Art des Defekts als auch nach Zugang zur Gesundheitsversorgung.Bis heute haben mehrere Studien die Folgen angeborener Anomalien nach Impfung der Mutter untersucht, sowohl bei empfohlener als auch bei versehentlicher Impfung.
Impfungen während der Schwangerschaft routinemäßig empfohlen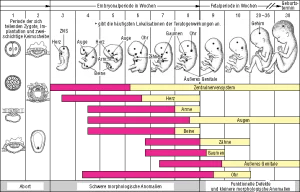
Influenza-Impfstoff, einschließlich saisonaler und pandemischer Impfstoffe Viele Länder empfehlen routinemäßig, dass schwangere Frauen jederzeit während der Schwangerschaft einen Influenza-Impfstoff erhalten . Daher sind Studien zur Bewertung des Potenzials dieser Impfstoffe, die Embryogenese oder Risiken für angeborene Anomalien zu beeinflussen, von entscheidender Bedeutung. Die mütterliche Immunisierung während der Schwangerschaft mit inaktiviertem Influenza-Impfstoff ist mit einem kurzzeitigen Anstieg der mütterlichen entzündlichen Biomarker verbunden. Zum Zeitpunkt der Veröffentlichung lagen keine Daten vor, die einen Zusammenhang zwischen der entzündlichen Reaktion der Mutter auf die Impfung und der fötalen Entwicklung und dem Risiko für angeborene Anomalien belegen.Bis März 2014 wurden Daten zu angeborenen Anomalien von mehr als 4000 schwangeren Frauen, die verschiedene Arten von adjuvantierten und nicht-adjuvantierten Grippeimpfungen im ersten Trimenon und über 19.000 in jedem Trimester erhielten, veröffentlicht und umfassend überprüft . Von den Einzelstudien berichtete die größte, die Expositionen im ersten Trimester umfasste, über Schwangerschaftsausgänge bei 323 Frauen, die mit adjuvantierten oder nicht-adjuvantierten A(H1N1)v2009-Influenza-Impfstoffen und 1329 Kontrollpersonen immunisiert wurden. Die Rate schwerer Fehlbildungen unterschied sich nicht zwischen den beiden Kohorten (alle Trimester: OR 0,87; 95 % Konfidenzintervall 0,38, 1,77; Präkonzeption und Exposition im ersten Trimester: OR 0,79; 95 % KI 0,13, 2,64). Die Review-Autoren kamen zu dem Schluss, dass die Influenza-Impfung der Mutter nicht mit einem erhöhten Risiko für angeborene Fehlbildungen verbunden ist. Statistische Ungenauigkeiten und klinische und methodische Heterogenität der eingeschlossenen Studien machten es jedoch unmöglich, Schäden vollständig auszuschließen. 2014 Cochrane Systematische Überprüfung, die fünf Studien in einer Metaanalyse kombinierte, ergab auch, dass eine Influenza-Immunisierung während der Schwangerschaft nicht mit einem höheren Risiko für angeborene Anomalien verbunden war, gepoolt Schätzung OR 1,06 (95 % KI, 0,90; 1,25) .Seit März 2014 wurden mindestens drei retrospektive Studien veröffentlicht, in denen die Folgen angeborener Anomalien nach monovalenten Influenza-A (H1N1)-Impfstoffen untersucht wurden. Die größte der drei Studien wurde in der Lombardei, Italien, während der Pandemieperiode (1. Oktober 2009 bis 30. September 2010) durchgeführt und umfasste 6246 schwangere Frauen, die mit einem MF59-adjuvantierten Pandemie-A (H1N1)-Impfstoff immunisiert wurden. Schwangerschaften wurden ausgeschlossen, wenn im Geburtenregister entweder Chromosomenaberrationen oder angeborene Virusinfektionen gemeldet wurden. Fälle wurden mit ICD-9-Codierung identifiziert und gemäß den EUROCAT-Richtlinien aufbewahrt. Die nicht übereinstimmende Analyse identifizierte 284/6.246 (4,5 %) Fälle von angeborenen Fehlbildungen in der immunisierten Kohorte und 3.246/79.925 (4,1 %) in der nicht immunisierten Kohorte, OR 1,13 (95 % KI, 0,99; 1,28) und Propensity-matched OR 1,14 (95 % KI, 0,99, 1,31). Preise und Schätzungen waren auch für spezifische Anomalien verfügbar.Tetanus-Diphtherie, azellulärer Pertussis-Impfstoff (Tdap) Viele Länder empfehlen die Verabreichung des azellulären Pertussis-Impfstoffs während des dritten Schwangerschaftstrimesters. Eine randomisierte kontrollierte Placebo-Studie, die von 2008 bis 2012 durchgeführt wurde, untersuchte die Folgen angeborener Anomalien bei Säuglingen nach mütterlicher Tdap-Verabreichung während der Schwangerschaft. Zwischen der 30. und 32. Schwangerschaftswoche erhielten 33 Frauen den Tdap-Impfstoff und 15 einen Placebo-Impfstoff mit Crossover-Immunisierung nach der Geburt. In der geimpften Kohorte hatte ein Säugling eine angeborene Anomalie, im Vergleich zu zwei Säuglingen mit angeborenen Anomalien in der Kontrollgruppe. Bisher wurden in den Vereinigten Staaten zwei retrospektive Beobachtungsstudien zur Verabreichung von Tdap während der Schwangerschaft veröffentlicht; beide weisen darauf hin, dass bei Säuglingen von Müttern, die während der Schwangerschaft geimpft wurden, kein signifikant erhöhtes Risiko für schwere angeborene Anomalien besteht. Die verbleibenden Beweise für die Sicherheit von Pertussis-haltigen Impfstoffen stammen aus der passiven Überwachung.
Tetanus bei Müttern und Neugeborenen bleibt problematisch in geografischen Gebieten, in denen die Geburt unter Bedingungen erfolgt, die nicht den hygienischen Mindeststandards entsprechen, und die Durchimpfungsrate der Bevölkerung gering ist. In diesen Regionen wird Frauen mit unzureichender Immunisierung in der Vorgeschichte empfohlen, so früh wie möglich während der Schwangerschaft zwei Dosen eines Tetanustoxoid (TT)-haltigen Impfstoffs zu erhalten. Zwischen 1959 und 1965 wurde in den Vereinigten Staaten eine große prospektive Studie durchgeführt, die 337 Mutter-Kind-Paare einschloss, die vor der 20. Schwangerschaftswoche auf TT-Impfstoff-Exposition untersucht wurden. Die Autoren schätzten ein standardisiertes relatives Risiko (SRR) von 1,19 (95 % KI, 0,70, 1,87) für jede Anomalie nach einer Tetanusimpfung während der Schwangerschaft. In neueren Fall-Kontroll-Studien wurde kein erhöhtes Risiko für angeborene Anomalien nach maternaler TT-Impfung beobachtet . In einer dieser Studien wurden 30 Frauen (55 % der geimpften Frauen) während der ersten drei Schwangerschaftsmonate exponiert. In der anderen wurde der Zeitpunkt der Impfung während der Schwangerschaft nicht angegeben.Während der Schwangerschaft versehentlich verabreichte Impfungen Frauen im gebärfähigen Alter werden routinemäßig viele Impfstoffe verabreicht, wodurch sich die Wahrscheinlichkeit einer versehentlichen Impfung während der Schwangerschaft erhöht. Daher bleibt die kontinuierliche Überwachung der Geburtsergebnisse bei Frauen, die versehentlich während der Schwangerschaft exponiert wurden, eine Priorität. Lebendvirusimpfstoffe (Röteln, Masern, Mumps, orales Poliovirus, Gelbfieber und Windpocken) Die versehentliche Impfung der Mutter mit einem Lebendvirusimpfstoff ist mit einer Replikation des Impfvirus und wahrscheinlich einer robusteren Entzündungsreaktion der Mutter verbunden als bei inaktivierten Impfstoffen. Besorgniserregender ist jedoch, dass mütterliche Infektionen mit Röteln, Varizellen, Cytomegalovirus und anderen Viren während kritischer Phasen der fötalen Entwicklung mit bestimmten Gruppen angeborener Anomalien oder Syndrome in Verbindung gebracht werden . Daher besteht ein theoretisches Risiko, dass eine versehentliche Impfung der Mutter mit einem Lebendimpfstoff zu einer fötalen Infektion führt und anschließend das Risiko für eine oder mehrere angeborene Anomalien erhöht.Eine Überprüfung der versehentlichen Verabreichung von Lebendimpfstoffen (monovalente oder kombinierte Röteln-, orale Poliomyelitisvirus- und Gelbfieberimpfstoffe) an Schwangere ergab keine Hinweise auf unerwünschte Schwangerschaftsausgänge. Die Inzidenz des kongenitalen Rötelnsyndroms (CRS) nach versehentlicher Rötelnimpfung schwangerer Frauen wurde in mehreren Ländern in Europa, den Vereinigten Staaten, Kanada, Iran und Lateinamerika untersucht. Unter mehr als 3500 anfälligen Frauen, die versehentlich kurz vor oder im ersten Schwangerschaftstrimester gegen Röteln geimpft wurden, wurden keine Fälle von CRS gemeldet.
Es wurden keine spezifischen Studien zum Ausgang einer Schwangerschaft nach einer versehentlichen Masern- oder Mumps-Impfung durchgeführt. Die passive Überwachung der Impfexposition vor der Empfängnis und während der Schwangerschaft hat nicht auf ein erhöhtes Risiko für angeborene Missbildungen oder spontane Fehlgeburten hingewiesen [46], aber es liegen keine ausreichenden Informationen vor, um ein solches Risiko auszuschließen.Der orale Poliovirus-Impfstoff (OPV), der attenuierte Lebend-Poliovirus-Typen 1, 2 und 3 enthält, wird seit den 1960er Jahren häufig verwendet, um schwangere Frauen und Neugeborene vor Poliomyelitis zu schützen. Die mögliche Entwicklung einer Virämie nach der Immunisierung und einige Fälle, die auf impfstoffassoziierte Anomalien hindeuten, einschließlich eines ungeklärten Berichts über eine tödliche neuronale Schädigung des Rückenmarks nach einer mütterlichen Immunisierung bei einer immunen Mutter, wurden dokumentiert . Es liegen jedoch keine bevölkerungsbezogenen kontrollierten Studien vor, die die Bedeutung dieser Einzelberichte bestätigen. Als Reaktion auf eine Poliovirus-Epidemie in Finnland im Jahr 1985 wurde OPV an 94 % der Gesamtbevölkerung, einschließlich schwangerer Frauen, verabreicht. Bei Säuglingen, die OPV in utero ausgesetzt waren, wurde im Vergleich zu den erwarteten Raten kein Anstieg der Raten von Wachstumsverzögerung, perinatalen Todesfällen, Frühgeburten oder angeborenen Anomalien beobachtet.
Die Gelbfieberimpfung wurde bei mehreren hundert Schwangeren dokumentiert. Die Risiken eines unerwünschten Schwangerschafts- und Geburtsverlaufs scheinen denen in der Allgemeinbevölkerung ähnlich zu sein.Daten aus einem US-amerikanischen Register von schwangeren Frauen, die entweder 3 Monate vor oder zu einem beliebigen Zeitpunkt während der Schwangerschaft versehentlich einen Varizella-Impfstoff erhalten haben, zeigten, dass unter den 587 prospektiv aufgenommenen Frauen (einschließlich 131 Lebendgeburten von Frauen, von denen bekannt ist, dass sie das Varizella-Zoster-Virus haben) seronegativ), gab es keinen Hinweis auf ein kongenitales Varizellensyndrom . Die Häufigkeit des Auftretens angeborener Anomalien aus prospektiven Berichten im Register war ähnlich wie die gemeldeten Raten in der allgemeinen US-Bevölkerung (3,2 %), und die Anomalien zeigten kein spezifisches Muster oder Zielorgan.
Impfstoff gegen humanes Papillomavirus (HPV) Bisher basieren die Daten zur Sicherheit der bivalenten HPV- (2vHPV), 4-wertigen HPV- (4vHPV) und 9-wertigen HPV- (9vHPV) Impfstoffe, die versehentlich während der Schwangerschaft verabreicht werden, auf der klinischen Vorzulassung Studien und Überwachungsstudien nach dem Inverkehrbringen. Letztere waren größtenteils passive, freiwillige Registerüberwachungen, die sich für den 4vHPV-Impfstoff bis 2012 erstreckten und für den 9vHPV-Impfstoff seit der Zulassung durch die US-amerikanische FDA im Jahr 2015 andauern. Bis heute gibt es keine Daten, die auf ein erhöhtes Risiko hindeuten angeborene Missbildungen nach Exposition gegenüber HPV-Impfstoffen während der Schwangerschaft, aber die Gesamtzahl der Fälle war gering, was die statistische Aussagekraft potenziell einschränkt und die Möglichkeit ausschließt, Assoziationen der HPV-Impfstoffe mit spezifischen Anomalien definitiv auszuschließen.
Eine gepoolte Analyse von 42 klinischen Studien vor der Zulassung des 2vHPV-Impfstoffs mit 479 Schwangerschaften, bei denen das Datum der letzten Monatsblutung zwischen 30 Tagen vor und 45 Tagen nach der Impfung auftrat, ergab im Vergleich zu 414 Kontrollen kein erhöhtes Risiko für angeborene Anomalien bei ähnlichem Impfzeitpunkt. In ähnlicher Weise ergab eine gepoolte Analyse von fünf klinischen Studien vor der Zulassung des 4vHPV-Impfstoffs keinen signifikanten Unterschied in der Rate angeborener Anomalien, wenn 2008 schwangere Frauen, die eine Impfung erhielten, mit 2029 schwangeren Frauen verglichen wurden, die ein Placebo erhielten.Post-Marketing-Daten zur Sicherheit von HPV-Impfstoffen, die während der Schwangerschaft verabreicht werden, umfassen vom Hersteller gesponserte Register der 2vHPV- und 4vHPV-Impfstoffe, Berichte über den 4vHPV-Impfstoff an das Vaccine Adverse Event Reporting System (VAERS), ein passives Überwachungssystem in den Vereinigten Staaten, und eine beobachtende Kohortenstudie des 2vHPV-Impfstoffs, die unter Verwendung von Daten aus dem Vereinigten Königreich durchgeführt wurde. Freiwillige Meldungen sind dafür bekannt, angeborene Anomalien zu wenig zu melden, wenn sie nicht bei der Geburt entdeckt werden, und bei retrospektiven Meldungen kommt es häufig vor, dass Anomalien zu viel gemeldet werden. Die herstellergestützten Register haben daher nur prospektive Berichte über unbeabsichtigte Impfexpositionen für die Berechnung der kongenitalen Anomalieraten verwendet. Die vom Hersteller gesponserten Register beobachteten Gesamtraten schwerer angeborener Fehlbildungen, die mit den Hintergrundraten in den Populationen [5 von 189 lebend geborenen Säuglingen (2,6 %) und 37 von 1527 lebend geborenen Säuglingen (2,4 %), jeweils in der 2vHPV- und 2vHPV-Gruppe, übereinstimmten 4vHPV-Register. Darüber hinaus wurden in einer Analyse von 4vHPV-Impfberichten, die zwischen Juni 2006 und Dezember 2013 bei VAERS eingereicht wurden, nur zwei größere angeborene Missbildungen bei allen Säuglingen von 147 Frauen gemeldet, die während der Schwangerschaft 4vHPV erhalten hatten . Veröffentlichte Daten aus einer formalen epidemiologischen Studie zur Sicherheit von HPV-Impfstoffen während der Schwangerschaft nach der Zulassung stammen aus einer beobachtenden Kohortenstudie im Clinical Practice Research Datalink; kein Unterschied wurde im Prozentsatz angeborener Fehlbildungen beobachtet, die aus Schwangerschaften resultierten, bei denen der Schwangerschaftsbeginn zwischen 30 Tagen vor und 45 Tagen nach der 2vHPV-Impfung erfolgte (7 von 119 Schwangerschaften, 5,9 %) vs. 120 Tage bis 18 Monate nach der Impfung (23 von 350 Schwangerschaften, 6,6 %). Nakalembe et al. führten eine systematische Überprüfung von 14 Studien durch, die die Impfstoffsicherheit nach der Verabreichung von 2vHPV- und 4vHPV-Impfstoffen in Ländern mit niedrigem und mittlerem Einkommen bewerteten. Von den 14 Studien enthielten vier Informationen zu Schwangerschaftsausgängen; In diesen 4 Studien wurde kein Unterschied zwischen den Gruppen festgestellt.Die Ergebnisse der multinationalen, doppelblinden, randomisierten Phase-IIb/III-Studie mit 9vHPV bei 14.215 Frauen wurden kürzlich veröffentlicht. Eine Schwangerschaft wurde bei 1192 Teilnehmern in der 9vHPV-Gruppe und bei 1129 Teilnehmern in der 4vHPV-Gruppe berichtet. Daten zum Schwangerschaftsausgang waren für 85 % der Schwangerschaften verfügbar. Angeborene Anomalien wurden bei insgesamt 32 Säuglingen und 9 Föten berichtet, und die Raten unterschieden sich nicht zwischen den Gruppen (20 in der 9vHPV-Gruppe und 21 in der 4vHPV-Gruppe). Bei Schwangerschaften mit einem geschätzten Empfängnisdatum innerhalb von 30 Tagen vor oder nach der Verabreichung des 4vHPV- oder 9vHPV-Impfstoffs (dies entspricht 8 % der Schwangerschaften mit bekanntem Ausgang) wurden keine angeborenen Anomalien berichtet.
Meningokokken-Impfung Es gibt nur wenige Beweise für die Sicherheit der Verabreichung einer Meningokokken-Impfung während der Schwangerschaft. Eine 2012 durchgeführte systematische Überprüfung identifizierte 6 Studien zur Bewertung der Sicherheit des Meningokokken-Polysaccharid-Impfstoffs (MPSV) in der Schwangerschaft. Keine der eingeschlossenen Studien deutete auf unerwünschte Folgen, einschließlich Geburtsfehler, für Säuglinge von Müttern hin, die während der Schwangerschaft MPSV erhalten hatten. Die gesamte Studienpopulation umfasste jedoch 335 Frauen, was möglicherweise zu klein ist, um seltene Ergebnisse wie angeborene Anomalien zu bewerten.Die Sicherheitsinformationen zu Meningokokken-Konjugatimpfstoffen (MCV) stammen aus der passiven Überwachung. Diese Daten deuten nicht auf schädliche Ereignisse bei Geburtsergebnissen hin, einschließlich angeborener Anomalien, wenn MCV schwangeren Frauen verabreicht wird. Bisher liegen keine Daten zur Sicherheit neuer Meningokokken-B-Impfstoffe bei Verabreichung während der Schwangerschaft vor. Zusammenfassung des Hintergrunds Die Hinweise auf potenzielle Risiken für angeborene Anomalien nach einer Immunisierung der Mutter sind größtenteils beruhigend. Bisherige Studien waren jedoch durch unzureichende Stichprobengrößen, unterschiedliche Definitionen für Ergebnisse und die Verwendung von biologisch nicht machbaren Expositionsfenstern begrenzt. Schätzungen zufolge treten bei 3 % der Schwangerschaften eine oder mehrere angeborene Anomalien auf . Spezifische isolierte Defekte treten jedoch im Allgemeinen mit Raten von 1 pro 10.000 bis 1 pro 100.000 Geburten auf. Angesichts der Variabilität von Arten und Ursachen von Geburtsfehlern werden zukünftige Studien zur Sicherheit von Impfstoffen für Mütter viel größere Stichprobenumfänge oder alternative Ansätze (z. B. Fall-Kontroll-Studien) erfordern, um Risiken für angeborene Anomalien, sowohl isolierte Fehler als auch Gruppen von Fehlern, zu erkennen.
Etablierte Definitionen Zwischen den verschiedenen Definitionen für angeborene Anomalien, die von auf angeborene Anomalien und Entwicklung spezialisierten Organisationen verwendet werden, bestehen feine Unterschiede. Das National Institute of Child Health and Human Development (NICHD), das Metropolitan Atlanta Congenital Defects Program (MACDP), das National Birth Defects Prevention Network (NBDPN) und der March of Dimes verwenden den Begriff „Geburtsfehler“, um angeborene Anomalien zu beschreiben. NBDPN unterteilt Geburtsfehler in größere und kleinere Anomalien. Die von diesen Organisationen verwendeten Definitionen konzentrieren sich sowohl auf strukturelle als auch funktionelle Anomalien, die bei der Geburt vorhanden sind und erhebliche gesundheitliche Folgen haben.Es gibt keine einheitlich akzeptierte Definition von angeborenen Anomalien, oder genauer gesagt von angeborenen Anomalien nach mütterlicher Immunisierung. Dies ist eine verpasste Gelegenheit, da die Vergleichbarkeit von Daten über Studien oder Überwachungssysteme hinweg die Dateninterpretation verbessern und das wissenschaftliche Verständnis des Ereignisses fördern würde. Durch die Bereitstellung standardisierter Falldefinitionen und Richtlinien soll dieses Dokument die Zuverlässigkeit und Vergleichbarkeit von Daten verbessern, die von immunisierten Patientinnen und Kontrollpersonen in klinischen Studien gesammelt wurden, sowie einen Rahmen für die konsequente Überwachung der Sicherheit von Impfstoffen bieten, die derzeit während der Schwangerschaft empfohlen werden oder verfügbar sind für Frauen im gebärfähigen Alter. Solche Daten können bei der Beurteilung verwendet werden, ob oder inwieweit ein während der Schwangerschaft verabreichter Impfstoff das Risiko einer Frau für eine Lebendgeburt oder einen fötalen Tod mit einer oder mehreren angeborenen Anomalien erhöhen kann. Die Falldefinitionen und Richtlinien sollen in verschiedenen geografischen, administrativen und kulturellen Regionen anwendbar sein und sowohl an ressourcenreiche als auch an ressourcenarme Umgebungen angepasst werden können.
Richtlinien für die Datenerhebung, -analyse und -darstellung Wie im Übersichtspapier erwähnt, wird die Falldefinition von Richtlinien begleitet, die nach den Schritten der Durchführung einer klinischen Prüfung, d. h. Datenerhebung, -analyse und -präsentation, strukturiert sind. Weder die Falldefinition noch die Leitlinien sind dazu bestimmt, Kriterien für die Behandlung kranker Säuglinge, Kinder oder Erwachsener zu leiten oder festzulegen. Beide wurden entwickelt, um die Datenvergleichbarkeit zu verbessern. Da viele Studien zu angeborenen Anomalien nach einer Immunisierung im Rahmen der Post-Marketing-Überwachung durchgeführt werden, hoffen wir, dass die folgenden Definitionen auch in Beobachtungsstudien angewendet werden können.
Falldefinition von schweren angeborenen Anomalien
Für alle Stufen diagnostischer Sicherheit.Eine große angeborene Anomalie ist ein struktureller oder funktioneller Defekt mit den folgenden drei Merkmalen:
- Pränatalen Ursprungs
- Zum Zeitpunkt der Lebendgeburt oder des Ablebens des Fötus oder in utero vorhande
- Beeinflussung (oder Tendenz zur Beeinflussung) der Gesundheit, des Überlebens oder der körperlichen oder kognitiven Funktion des Individuums
Die meisten strukturellen angeborenen Anomalien werden vor dem 2. Lebensjahr diagnostiziert, normalerweise innerhalb der ersten 6 Lebensmonate, und sind definiert durch:
Größere äußere Strukturmängel
-Diagnosesicherheit bei großen äußeren Strukturmängeln
- Veränderungen der äußeren Anatomie, die zum Zeitpunkt der Lebendgeburt sichtbar sind und über die unmittelbare Peripartalperiode hinaus bestehen bleiben, sofern sie nicht chirurgisch repariert werden
- ODER
- Veränderungen der äußeren Anatomie, die bei einer Totgeburt oder in den Empfängnisprodukten einer spontanen oder therapeutischen Abtreibung sichtbar sind
- UND
- Bestätigt durch die Dokumentation einer Diagnose, die von einem Kliniker mit Erfahrung in der Diagnose angeborener Anomalien und mit der höchsten morphologischen Ausbildung für die spezifische Situation erstellt wurde
- diagnostische Sicherheit bei großen äußeren Strukturmängeln
- Veränderungen der äußeren Anatomie, die zum Zeitpunkt der Lebendgeburt sichtbar sind und über die unmittelbare Peripartalperiode hinaus bestehen bleiben, sofern sie nicht chirurgisch repariert werden
- ODER
- Veränderungen der äußeren Anatomie, die bei einer Totgeburt oder in den Empfängnisprodukten einer spontanen oder therapeutischen Abtreibung sichtbar sind
- UND
- Bestätigt durch die Dokumentation einer Diagnose, die von einem Kliniker mit einiger Erfahrung in der Diagnose angeborener Anomalien gestellt wurde
- Stufe 3 der diagnostischen Sicherheit bei großen äußeren Strukturdefekten
- Veränderungen der äußeren Anatomie, die zum Zeitpunkt der Lebendgeburt sichtbar sind und über die unmittelbare Peripartalperiode hinaus bestehen bleiben, sofern sie nicht chirurgisch repariert werden
- ODER
- Veränderungen der äußeren Anatomie, die bei einer Totgeburt oder in den Empfängnisprodukten einer spontanen oder therapeutischen Abtreibung sichtbar sind****
- UND
- Bestätigt durch die Dokumentation einer Diagnose, die von einem ausgebildeten Gesundheitsdienstleister für Mütter oder Kinder mit mindestens minimaler Erfahrung in der Diagnose angeborener Anomalien erstellt wurde
- ODER
- Bei Lebendgeburten, bestätigt mit individuellen (ICD-9/ICD-10) Codes oder als Teil eines auf ICD-9/ICD-10-Codes basierenden Algorithmus, wenn das Ergebnis (individueller Code oder Algorithmus) validiert wurde**** *
- Stufe 4 der diagnostischen Sicherheit (unzureichende Evidenz zur Bestätigung) für größere äußere strukturelle Defekte
- Veränderungen der äußeren Anatomie, die zum Zeitpunkt der Lebendgeburt sichtbar sind und über die unmittelbare Peripartalperiode hinaus bestehen bleiben, sofern sie nicht chirurgisch repariert werden
- ODER
- Veränderungen der äußeren Anatomie, die bei einer Totgeburt oder in den Empfängnisprodukten einer spontanen oder therapeutischen Abtreibung sichtbar sind
- UND
- Bestätigt durch Überprüfung der Krankenakte
- ODER
- Bestätigt in Schadendaten (ICD-9/ICD-10-Diagnosen)
- Größere interne strukturelle Defekte
- Stufe 1 der diagnostischen Sicherheit bei größeren inneren Strukturdefekten*
- Veränderungen der inneren Anatomie, die zum Zeitpunkt der Lebendgeburt** vorhanden sind und über die unmittelbare Peripartumperiode hinaus andauern, es sei denn, sie werden chirurgisch behoben
- UND
- Bestätigt durch definitive bildgebende Untersuchung*** oder intraoperative Diagnose
- ODER
- Veränderungen der inneren Anatomie, die während der Autopsie für eine Totgeburt, einen spontanen oder therapeutischen Schwangerschaftsabbruch entdeckt wurden, bestätigt durch eine Dokumentation durch einen Pathologen oder anderen relevanten Subspezialisten
- Stufe 2 der diagnostischen Sicherheit bei größeren inneren Strukturdefekten
- Veränderungen der inneren Anatomie, die zum Zeitpunkt der Lebendgeburt** vorhanden sind und über die unmittelbare Peripartumperiode hinaus andauern, es sei denn, sie werden chirurgisch behoben
- UND
- Bestätigt durch die Dokumentation einer Diagnose, die von einem Kliniker mit Erfahrung in der Diagnose angeborener Anomalien und mit dem höchsten Grad an morphologischer Ausbildung für die spezifische Situation**** ohne endgültige Bildgebung oder intraoperative Bewertung erstellt wurde
- ODER
- Bei Totgeburten, spontanen oder therapeutischen Abtreibungen ist der innere Strukturdefekt durch Ultraschall oder andere bildgebende Verfahren pränatal sichtbar
- Stufe 3 der diagnostischen Sicherheit bei größeren inneren Strukturdefekten
- Veränderungen der inneren Anatomie, die zum Zeitpunkt der Lebendgeburt** vorhanden sind und über die unmittelbare Peripartumperiode hinaus andauern, es sei denn, sie werden chirurgisch behoben
- UND
- Bestätigt durch die Dokumentation einer Diagnose, die von einem Kliniker mit einiger Erfahrung in der Diagnose angeborener Anomalien gestellt wurde*****
- ODER
- Bestätigt unter Verwendung individueller (ICD-9/ICD-10) Codes oder als Teil eines auf ICD-9/ICD-10-Codes basierenden Algorithmus, wenn das Ergebnis (individueller Code oder Algorithmus) validiert wurde
Datenpräsentation
Diese Leitlinien stellen einen wünschenswerten Standard für die Präsentation und Veröffentlichung von Daten zu angeborenen Anomalien nach Impfungen dar, um eine Vergleichbarkeit der Daten zu ermöglichen, und werden als Ergänzung zu Daten empfohlen, die für die spezifische Studienfragestellung und -umgebung vorgelegt werden. Darüber hinaus wird empfohlen, sich auf bestehende allgemeine Richtlinien für die Präsentation und Veröffentlichung von randomisierten kontrollierten Studien, systematischen Übersichtsarbeiten und Metaanalysen von Beobachtungsstudien in der Epidemiologie zu beziehen (z Qualität der Berichte von Metaanalysen randomisierter kontrollierter Studien (QUORUM) bzw. von Metaanalysen von Observational Studies in Epidemiology (MOOSE).
Alle gemeldeten Ereignisse angeborener Anomalien sollten gemäß den in Leitlinie 31 aufgeführten Kategorien dargestellt werden.
Daten zu möglichen angeborenen Anomalien sollten gemäß den Richtlinien zur Datenerhebung und Datenanalyse vorgelegt werden.
Begriffe zur Beschreibung angeborener Anomalien wie „geringgradig“, „leicht“, „mäßig“, „hoch“, „schwer“ oder „erheblich“ sind höchst subjektiv, anfällig für weite Interpretationen und sollten vermieden werden, sofern sie nicht klar definiert sind.
Daten sollten mit Zähler und Nenner (n/N) (und nicht nur in Prozent) dargestellt werden, falls vorhanden.
Obwohl Nennerdaten von Überwachungssystemen für die Sicherheit von Impfungen in der Regel nicht ohne Weiteres verfügbar sind, sollte versucht werden, ungefähre Nenner zu ermitteln. Die Quelle der Nennerdaten sollte angegeben und Berechnungen von Schätzungen beschrieben werden (z. B. Herstellerdaten wie abgegebene Gesamtdosen, Berichterstattung durch das Gesundheitsministerium, Daten zur Abdeckung/Bevölkerung usw.).
Die Inzidenz der Fälle in der Studienpopulation ist darzustellen und im Text eindeutig als solche zu kennzeichnen. Es wäre nützlich, die Raten für diese Bedingungen mit den Hintergrundraten zu vergleichen. Zu den nützlichen Ressourcen gehören: EUROCAT-Prävalenztabellen (http://www.eurocat-network.eu/accessprevalencedata/prevalencetables). Dadurch können sowohl exponierte als auch nicht exponierte Kohorten mit einem externen Standard verglichen werden.Wenn die Verteilung der Daten verzerrt ist, sind Median und Spannweite normalerweise die geeigneteren statistischen Deskriptoren als ein Mittelwert. Allerdings sollten auch der Mittelwert und die Standardabweichung angegeben werden.Wir empfehlen, die Studien, die darauf ausgerichtet sind, kombinierte Ergebnisse zu angeborenen Anomalien zu bewerten, ebenfalls zu veröffentlichen oder Daten zur Verfügung zu stellen, die eine Beschreibung einzelner Anomalien enthalten. Dies wird möglicherweise eine Metaanalyse diskreterer Ergebnisse ermöglichen und dabei helfen, das Risiko weniger häufiger Anomalien zu definieren.
Jede Veröffentlichung von Daten zu angeborenen Anomalien sollte möglichst eine detaillierte Beschreibung der Methoden zur Datenerhebung und -analyse enthalten.